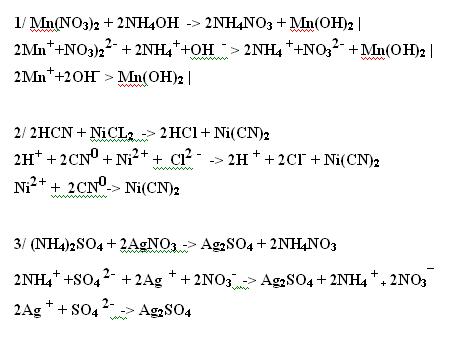(((
(((Задания =)
Заранее безумно благодарен!!! И очень признателен откликнувшимся!
Крайний срок 26 декабря
 (((
(((
Здравствуйте. Помогите пожалуйста с химией прошу пожалуйста
№1 На сколько градусов надо увеличить t , ЧТОБЫ СКОРОСТЬ РЕАКЦИИ возврасла в 27 раз . Температурный коэфициент равен 3. №2 Как повлияет увеличение давления на химическое равновесие в обратной системе . Fe2 O3 (K) + 3H(2) => 2Fe (K) + 3H2O (2) <= №3 Определите скорость химической реакции a+b=ab , если начальная концентрация вещества _a_ была равной 1 моль/литр, а через 4 секунды концентрация этого вещества стала 0,6 моль/литр . №4 Чему равен температурный коэфициент если при повышении t на 40 градусов её скорость увеличилась в 256 раз . ?решите пжалуйста